В статті представлені результати вивчення впливу сучасних антисептичних засобів декасану та горостену на клінічні штами Streptococcus sanguinis, отримані від пацієнтів із запальними захворю- ваннями слизової оболонки порожнини рота. Чутливість досліджуваних культур мікроорганізмів до означених препаратів визначали кількісним методом серійних розведень за стандартною методи- кою. Крім цього, велика увага приділяється чутливості Streptococcus sanguinis до антибіотиків різ- них фармакологічних груп та виникненню резистентності даних штамів до них. Метою досліджен- ня було вивчення протимікробної дії декасану та горостену щодо клінічних штамів Streptococcus sanguinis та визначення їх мінімальної інгібуючої та бактерицидної концентрацій (МІК, МБК). Вияви- лося, що досліджувані клінічні штами мікроорганізмів є резистентними до дії макролідів та лінкоса- мінів. В свою чергу, декасан та горостен володіють вираженим антибактеріальним впливом на Streptococcus sanguinis, що робить їх перспективними у лікуванні бактеріальних інфекцій у стома- тології.
Ключові слова: горостен, декасан, Streptococcus sanguinis, чутливість, антибіотики
Дана робота виконана в рамках НДР «Вивчення багатовекторності властивостей лікарського антимікробного препарату декаметоксину®», № державної реєстрації 0115U006000.
Відомо, що зубна бляшка або біоплівка є ключовим етіологічним фактором виникнення карієсу зубів та запальних захворювань періодонту. Колонізація бактеріями зубних поверхонь, стоматологічних матеріалів, які присутні в порожнині рота (імплантати, пломбувальні матеріали, ортопедичні конструкції), сприяє формуванню власного екологічно збалансованого мікробіоценозу порожнини рота [1,2]. Одними з найперших бактерій, що ініціюють процес формування зубної бляшки, можна вважати Streptococcus sanguinis, який протягом декількох хвилин прикріплюється до поверхні зубної пелікули [3].
sanguinis – грампозитивний, сферичний, факультативно-анаеробний мікроорганізм, який належить до нормальної мікрофлори ротової порожнини людини. S. sanguinis виявляють найчастіше в складі зубної бляшки [4,5]. Крім цього, цей стрептокок в числі перших заселяє порожнину рота дітей, починаючи з 9 місячного віку. Його асоціюють з раннім карієсом в дитячому віці [6,7].
За даними літературних джерел, S. sanguinis все частіше визначають збудником інфекційних ендокардитів та серйозних ендоваскулярних інфекцій у імуноскомпрометованих осіб, що сприяє зацікавленості науковців у більш детальному вивченні його біологічних властивостей та пошуку засобів антибактеріальної боротьби [4].
Проблема зростання резистентності умовнопатогенних мікроорганізмів до антибіотиків набуває все більших масштабів. S. sanguinis – не виключення. Досить давно відомо, що даний мікроорганізм стійкий до макролідів, лінкозамідів. Тому пошук нових протимікробних засобів для боротьби з бактеріальною інфекцією та антибіотикорезистентністю є нагальною проблемою сучасної медицини, шляхом подолання якої може бути застосування сучасних антисептичних засобів. Антисептики належать до найбільш поширених, ефективних протимікробних лікарських засобів, які використовують для профілактики, лікування захворювань мікробної етіології [8,9,10,11,12].
Слід зазначити, що існує досить тривалий досвід успішного використання препаратів декаметоксину у клінічній практиці. Подальші дослідження властивостей, ефективності декаметоксину (ДКМ) мають беззаперечну актуальність та перспективи [13].
Мета дослідження
Вивчення протистафілококової активності антибіотиків та антисептиків декасану, горостену щодо клінічних штамів Streptococcus sanguinis, виділених зі слизової оболонки стоматологічних хворих.
Матеріали та методи дослідження
Об’єктом досліджень були 22 клінічних штами Streptococcus sanguinis, виділені зі слизової оболонки порожнини рота за умов запального процесу. Культивування штамів проводили протягом 24-48 годин на тіогліколевому поживному середовищі, виробництва Інституту вакцин та імунних сироваток ім. І.І. Мечникова РАМН (Москва), з додаванням 1,5% агару «Дифко», 5% крові та 0,5-1% дріжджового гідролізату, як стимулятора росту мікроорганізмів при температурі 37°С. Заключну ідентифікацію проводили за допомогою автоматичного бактеріологічного аналізатора Vitec – 2 compact bioMаrieux (Франція) згідно інструкції виробника.
Чутливість отриманих штамів мікроорганізмів до декасану та горостену визначали методом подвійних серійних розведень, до антибіотиків диско-дифузійним методом відповідно до наказу МОЗ України за №167 від 05.04.2007р. «Про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів» [14]. Статистичну обробку отриманих результатів проводили за допомогою програми Microsoft Excel. Аналіз достовірності – за критерієм Ст’юдента.
Результати та їх обговорення
Досліджувані клінічні штами S. sanguinis виявилися чутливими до більшості антибіотиків різних фармакологічних груп, однак в різній мірі (табл.1).
Встановлено, що всі досліджувані штами S. sanguinis були резистентними до лінкоміцину, олеандоміцину та ампіциліну. Помірну стійкість до лінкоміцину, олеандоміцину та ампіциліну проявляв лише один штам стрептококу. В дослідженні встановлено високі протимікробні властивості фторхінолонів. S. sanguinis володіли високою чутливістю до офлоксацину (100 %), ципрофлоксацину (91 %). Аміноглікозиди, в свою чергу, виявились мало ефективними щодо S. sanguinis. Так, чутливість до гентаміцину не перевищувала 46 % (табл.1).
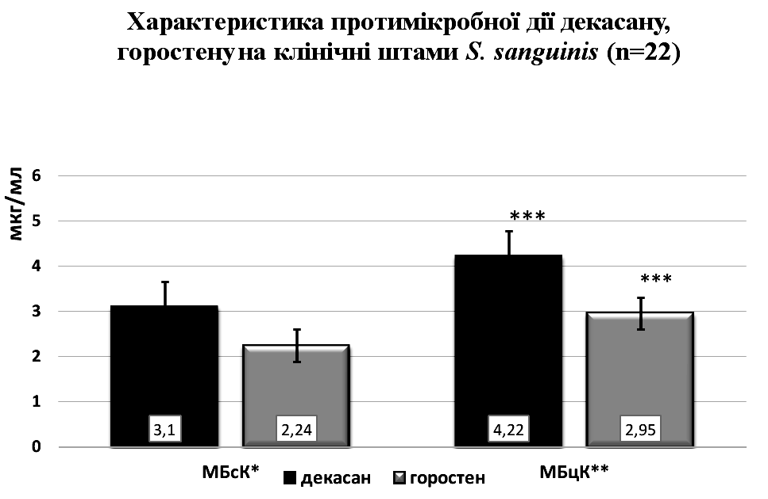
Цікавим є те, що досліджувані антисептичні лікарські засоби декаметоксину декасан та горостен виявилися досить активними щодо всіх клінічних штамів S. sanguinis. Рис.1
Таблиця 1 — Чутливість Streptococcus sanguinis до антибактеріальних препаратів (n = 22)
|
Антибактеріальний препарат |
Ступінь чутливості | |||||
| ч | п/с | р | ||||
| абс. | % | абс. | % | абс. | % | |
| Гатіфлоксацин | 19 | 86 | 2 | 9 | 1 | 5 |
| Ципрофлоксацин | 20 | 91 | 2 | 9 | — | — |
| Офлоксацин | 22 | 100 | — | — | — | — |
| Тетрациклін | 2 | 9 | 4 | 18 | 16 | 73 |
| Гентаміцин | 10 | 46 | 6 | 27 | 6 | 27 |
| Лінкоміцин | — | — | 1 | 4,5 | 21 | 95,5 |
| Кліндаміцин | — | — | 2 | 9 | 20 | 91 |
| Еритроміцин | 1 | 4,5 | 1 | 4,5 | 20 | 91 |
| Олеандоміцин | — | — | 1 | 4,5 | 21 | 95,5 |
| Ампіцилін | — | — | 1 | 4,5 | 21 | 95,5 |
| Цефоперазон | 1 | 4,5 | 3 | 14 | 18 | 77,5 |
Примітка: ч – чутливі; п/с – помірно стійкі; р – резистентні.
Примітка: *- мінімальна бактеріостатична концентрація; **- мінімальна бактерицидна концентрація; ***- достовірність від- мінностей показника МБцК горостену до показника МБцК, декасан у, р<0,05.
Так, затримку росту досліджуваних мікроорганізмів в рідкому поживному середовищі визначали в присутності мінімальної бактеріостатичної концентрації (МБсК) декасану 3,1±2,23 мкг/мл, а його мінімальна бактерицидна концентрація (МБцК) щодо S. sanguinis не перевищувала 4,22±0,7 мкг/мл.
В свою чергу, горостен проявив вищу протимікробну активність. Бактеріостатичну дію на клінічні штами досліджуваних мікроорганізмів визначали в присутності 2,24±0,9 мкг/мл. Бактерицидні властивості горостену щодо S. sanguinis спостерігали при застосуванні МБцК 2,95±0,43 мкг/мл (Рис.1). Доведено високі антимікробні властивості декасану та горостену щодо S. sanguinis, який колонізує ротову порожнину хворих із запальними захворюваннями слизової оболонки, в порівнянні з антибіотиками.
Висновок
Досліджувані клінічні штами S. sanguinis, які виділяють з порожнини рота пацієнтів при запальних захворюваннях слизової оболонки, мають високу резистентність до лікоміцину, кліндаміцину, еритроміцину, олеандоміцину, ампіциліну, тетрацикліну та цефоперазону; зберігають високу чутливість до дії декасану та горостену. Такі високі протимікробні властивості даних антисептичних препаратів підвищують науковопрактичний інтерес до сучасного антисептичного засобу декаметоксину та його лікарських форм з перспективою їх подальшого всебічного вивчення, як альтернативи в лікуванні і профілактиці виникнення бактеріальних інфекцій у стоматології.
Література
- Hauser-Gerspach. Adhesion of Streptococcus sanguinis to dental implant and restorative materials in vitro / Hauser-Gerspach, Eva
- Kulik, R. Weiger [et al.] // Dental Materials Journal. – 2007. –V. 26 (3). – P.361-366.
- Kreth J. Streptococcal Antagonism in Oral Biofilms: Streptococcus sanguinis and Streptococcus gordonii Interference with Streptococcus mutans/ J. Kreth, Y. Zhang, M.C. Herzberg // Journal Of Bacteriology. – 2008. — V.190, No. 13. -P. 4632–4640.
- Oral microbiology / [P. D. Marsh, V. Martin, O. Lewis,
- Williams]. – [5th Edition]. — Churchill Livingstone, 2009. — 232p.
- Paik S. Identification of Virulence Determinants for Endocarditis in Streptococcus sanguinis by Signature-Tagged Mutagenesis / S. Paik, L. Senty, S. Das [et al.] // Infection And Immunity. – 2005. — V. 73, No. 9. — P. 6064–6074
- Ge X. Identification of Streptococcus sanguinis genes required for biofilm formation and examination of their role in endocarditis virulence / X. Ge, T. Kitten, Z. Chen [et al.] // Infection And Immunity. – 2008. — V. 76, No. 6. — P. 2551–2559
- Ge Y. Streptococcus mutans and Streptococcus sanguinis colonization correlated with caries experience in children / Y. Ge,
- Caufield, G. S. Fisch, Y. Li // Caries Res. – 2008. – V. 42. — P.444-448.
- Caufield Page Natural history of streptococcus sanguinis in the oral cavity of infants: evidence for a discrete window of infectivity /
- W. Caufield, A. P. Dasanayake, Y. Li [et al.] // Infection And Immunity. – 2000. — V. 68, No. 7. — P. 4018–4023.
- Horinouchi Sueharu. A complex attenuator rqgulates inducible resistance to macrolides, lincosamides, and streptogramin type b antibiotics in Streptococcus sanguis / S. Horinouchi, H. Byeon,
- Weisblum // Journal of bacteriology. – 1983. — V. 154, No. 3. — P. 1252-1262.
- Палій Г.К. Дослідження чутливості збудників гнійно-запальних захворювань до сучасних антимікробних препаратів / Г. К. Палій, О. А. Назарчук, Г. Г. Назарчук [ та ін.] // Журнал вушних, носових і горлових хвороб. – 2014. – № 1. – С. 52-57.
- Береза Б. М. Протимікробна ефективність антисептиків у місцевому лікуванні захворювань порожнини рота / Б. М. Береза, П. О. Кравчук, В. М. Буркот // Довкілля і здоров’я : Всеукраїнська наук.-прак. конф., 25 квіт. 2014 р. : матеріали конф. – Тернопіль, 2014. – С. 79-80.
- Назарчук О.А. Чутливість клінічних штамів aureus до антибактеріальних препаратів / О. А. Назарчук, Г. Г. Назарчук, Д. В. Палій, В. В. Сухляк // Український медичний часопис. – 2012. –№ 3 (89). – С. 107–109.
- Сухляк В.В. Мікробіологічне обґрунтування ефективності декасану у пацієнтів із захворюванням слизової оболонки порожнини рота / В. В. Сухляк, Д. В. Палій, Г. М. Побережна, Н. С. Скрибан // Biomedical and Biosocial Anthropology. – 2012. – № 18. – С. 95–98.
- Палій Г.К. Новий препарат горостен для антисептики рук / Г.К. Палій [та ін.] // Biomedical and biosocial anthropology. – 2010. -№15. – С. 16-19.
- Наказ МОЗ України «Про затвердження методичних вказівок
«Визначення чутливості мікроорганізмів до антибактеріальних препаратів» від 05.04.2007 р. № 167.