Грамнегативні неферментуючі мікроорганізми посідають вагоме місце серед біоплівкоутворюючих мікроорганізмів, які приймають участь у розвитку тяжких захворювань пацієнтів з імунодефіцитними станами. Інфекції, викликані даними збудниками, характеризуються хронічним довготривалим перебігом та суттєвими труднощами їх етіотропної терапії у зв’язку з набуттям додаткової резистентності до дії протимікробних засобів. Мета – дослідження впливу сучасних антисептичних засобів на біоплівкоутворення клінічних штамів грамнегативних мікроорганізмів, що виділені за умов інфекційно-запальних ускладнень одонтоімплантації. Матеріали та методи дослідження. Від обстежених хворих було виділено та ідентифіковано 25 штамів грамнегативних мікроорганізмів. Серед них ідентифіковано бактерії роду Pseudomonas spp. (n=13) та Acinetobacter spp. (n=12). Чутливість отриманих клінічних ізолятів до антисептиків (декасану, горостену, хлоргексидину біглюконату) визначали кількісним методом двократних серійних розведень за стандартною методикою відповідно до наказу МОЗ України №167 від 05.04.2007 р. «Про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів». Вивчення біоплівкоутворюючих властивостей клінічних ізолятів визначали за допомогою спектрофотометричного методу за G.D. Christensen (MtP-test «microtiter plate test”). Властивості мікроорганізмів утворювати біоплівки оцінювали за ступенем поглинання барвника у одиницях щільності (ОЩ). Результати дослідження. Декасан в суббактеріостатичній концентрації пригнічує утворення біоплівок клінічними штамами P. aeruginosa протягом перших 24 год. культивування. Клінічні ізоляти P. aeruginosa, які знаходяться у сформованій біоплівковій формі, виявляють високу чутливість до суббактеріостатичних концентрацій антисептиків на основі декаметоксину (декасан, горостен). Присутність антисептичних засобів не впливає на процес утворення біоплівок клінічними штамами A. baumannii. в першу добу культивування, проте суббактеріостатичні концентрації декасану, горостену та хлоргексидину суттєво пригнічують сформовані дводобові біоплівкові форми A. baumannii. Висновок. Грамнегативні неферментуючі бактерії, що колонізують периімплантатну ділянку за умов ускладнень дентальної імплантації, володіють високими біоплівкоутворюючими властивостями. Сучасні антисептичні засоби впливають на процес утворення біоплівок на різних етапах їх формування.
Ключові слова: біоплівка, чутливість до антисептиків, грамнегативні бактерії, одонтоімплантація
Починаючи з 80-х років минулого століття, питання біоплівкоутворення різними мікроорганізмами та його вплив на розвиток патологічних процесів привертає все більше уваги як науковців, так і лікарів-практиків. Адже відомо, що утворення мікроорганізмами біоплівок на поверхнях медичного обладнання, імплантатів та власне тканин організму людини призводить до біоплівко-асоційованих інфекцій, які досить важко піддаються лікуванню [2;4;6;8;12].
Останнім часом з’являється все більше даних про роль біоплівкоутворюючих мікроорганізмів у розвитку тяжких захворювань пацієнтів з імунодефіцитними станами. Грамнегативні неферментуючі мікроорганізми посідають вагоме місце серед них. Здатність Pseudomonas spp. та Acinetobacter spp. існувати в умовах середовища лікувальних закладів, прикріплюватися до різних поверхонь та протистояти зовнішнім факторам агресії свідчить про їх провідне значення серед відомих збудників інфекційних ускладнень, пов’язаних з наданням медичної допомоги. Інфекції, викликані даними збудниками, характеризуються хронічним довготривалим перебігом та суттєвими труднощами їх етіотропній терапії. Адже у складі біоплівок збудники набувають додаткової резистентності до дії протимікробних засобів [1;7;9;10].
Враховуючи дані особливості, актуальним залишається необхідність пошуку альтернативних ефективних засобів, які володіють протимікробною дією як щодо планктонних форм антибіотикорезистентних збудників інфекційнозапальних ускладнень одонтоімплантації, так і у формі біоплівок. Це обумовлює науковий інтерес до вивчення процесу біоплівкоутворення в клінічно значимих збудників безпосередньо та за умов наявності різних протимікробних засобів [3;5].
Мета
Дослідження впливу сучасних антисептичних засобів на біоплівкоутворення клінічних штамів грамнегативних мікроорганізмів, що виділені за умов інфекційно-запальних ускладнень одонтоімплантації.
Матеріали та методи дослідження
У дослідженні було обстежено 46 пацієнтів середньої вікової групи за ВООЗ (середній вік 47±5,32 років) з включеними дефектами зубних рядів у боковій ділянці, яким було встановлено від 1 до 4 розбірних титанових імплантатів, за результатами клінічних і рентгенологічних методів діагностовано периімплантатний мукозит та периімплантит. Для виділення, дослідження біологічних властивостей аеробної та факультативно-анаеробної мікрофлори виконували забір матеріалу з периімплантатних кишень стерильним паперовим ендодонтичним штифтом стандартного розміру (№30) шляхом просочування, з подальшим культивуванням на елективних, селективних середовищах та ідентифікацією мікроорганізмів стандартними мікробіологічними методами.
Від обстежених хворих було виділено та ідентифіковано 25 штамів грамнегативних мікроорганізмів. Серед них ідентифіковано бактерії роду Pseudomonas spp. (n=13) та Acinetobacter spp. (n=12). Чутливість отриманих клінічних ізолятів до антисептиків (декасану, горостену, хлоргексидину біглюконату) визначали кількісним методом двократних серійних розведень за стандартною методикою відповідно до наказу МОЗ Укр їни №167 від 05.04.2007 р. «Про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів». Кількісні характеристики протимікробної дії антисептиків у мкг/мл визначали за мінімальною інгібуючою концентрацією (МІК) препаратів у рідкому поживному середовищі та їх мінімальною бактерицидною концентрацією (МБцК) шляхом посіву на чашки Петрі зі щільним поживним середовищем. Антисептичні лікарські препарати закупляли в аптеках.
Вивчення біоплівкоутворюючих властивостей клінічних ізолятів визначали за допомогою спектрофотометричного методу за G.D. Christensen (MtP-test «microtiter plate test”). Біоплівки відтворювали в лунках стерильного плоскодонного 96лункового полістеролового планшету (Corning, США) з додаванням суббактеріостатичних концентрацій та МІК антисептиків та забарвлювали 1%-м розчином кристалічного фіолетового. Властивості мікроорганізмів утворювати біоплівки оцінювали за ступенем поглинання барвника у одиницях щільності (ОЩ) спектрофотометрично (570 нм). Інтерпретацію результатів проводили відповідно до відомої методики. Так, здатність мікроорганізмів до утворення біоплівок оцінювали як низьку (ОЩ<0,120), середню (ОЩ = 0,121-0,239) та високу (ОЩ>0,240) [11;13].
Результати та їх обговорення
Останнім часом на вітчизняному фармакологічному ринку добре себе зарекомендували антисептики з групи четвертинних амонієвих сполук на основі декаметоксину (декасан, горостен). Проведені дослідження довели їх протимікробну дію щодо клінічних штамів Pseudomonas spp. та Acinetobacter spp. (табл. 1).
Таблиця 1 — Чутливість досліджуваних клінічних штамів мікроорганізмів до антисептиків, мкг/мл, M±m
| Мікроорганізми | n | Декасан | Горостен | Хлоргексидин біглюконат | |||
| МБцК | МІК | МБцК | МІК | МБцК | МІК | ||
| P. aeruginosa | 13 | 79,96±29,6 | 39,42±19,08 | 61,30±30,32 | 41,47±22,56 | 115,38±50,3 | 73,32±31,80 |
| A. baumannii | 12 | 28,13 ±19,3 | 13,28 ±5,9 | 23,43 ±16,9 | 12,04 ±6,2 | 37,11 ±27,3 | 18,55 ±11,6 |
Так, МБцК декасану та горостену щодо клінічних ізолятів P. aeruginosa становили 79,96±29,6 мкг/мл та 61,30±30,32 відповідно. У свою чергу, МБцК хлоргексидину біглюконату щодо означених збудників визначали дещо вищими (115,38±50,3 мкг/мл). Клінічні штами baumannii проявили найбільшу чутливість до дії горостену, МБцК якого щодо даних штамів не перевищували 23,43±16,9 мкг/мл. МБцК горостену та хлоргексидину біглюконату щодо baumannii незначно перевищували МБцК декасану і становили 28,13 ±19,3 мкг/мл та 37,11 ±27,3 мкг/мл відповідно.
Доведено, що МІК декасану (39,42±19,08 мкг/мл) щодо клінічних штамів P. aeruginosa, у 1,9 разів нижча за МІК хлоргексидину біглюконату (73,32±31,80 мкг/мл) щодо даних мікроорганізмів. Досліджувані антисептичні засоби чинили інгібуючу дію щодо штамів A. baumannii у концентраціях 13,28±5,9 мкг/мл декасану, 12,04±6,2 мкг/мл горостену та 18,55±11,6 мкг/мл хлоргексидину біглюконату.
За результатами проведених досліджень встановлено меншу ефективність хлоргексидину біглюконату відносно грамнегативних неферментуючих бактерій, які колонізували периімплантатну ділянку за умов інфекційно-запальних ускладнень одонтоімплантації, порівняно з антисептиками на основі декаметоксину. Однак достовірної різниці між даними показниками не виявлено.
Базуючись на отриманих результатах чутливості досліджуваних клінічних штамів мікроорганізмів до антисептичних засобів, були обрані суббактеріостатичні концентрації препаратів для оцінки їх впливу на біоплівкоутворення збудниками родів Pseudomonas spp. та Acinetobacter spp. Здатність формувати біоплівки P. aeruginosa досліджували у присутності 25 мкг/мл декасану, 31,25 мкг/мл горостену та 62,5 мкг/мл хлоргексидину біглюконату. Вплив антисептиків на біоплівкоутворення клінічними штамами baumannii досліджували в присутності суббактеріостатичних концентрацій декасану (12,5 мкг/мл), горостену (7,81 мкг/мл) та хлоргексидину (15,63 мкг/мл).
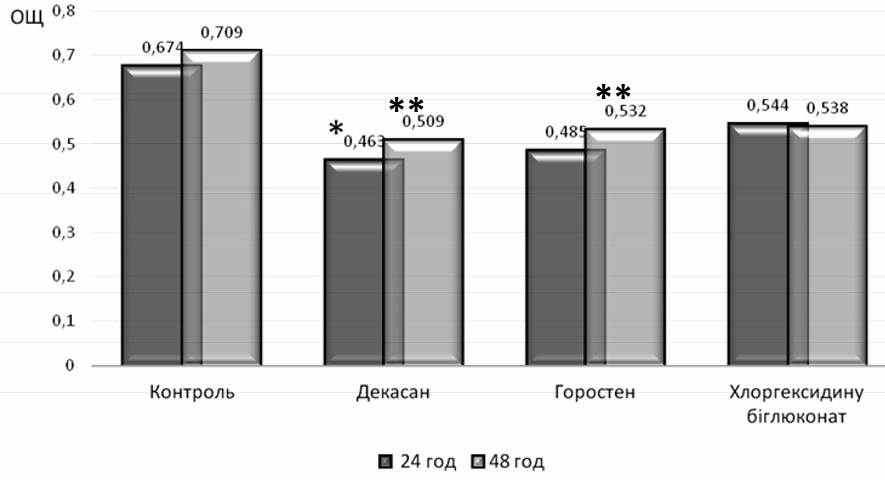
Встановлено, що досліджувані клінічні ізоляти володіли високою здатністю до біоплівкоутворення. Так, ступінь поглинання барвника біоплівками, які продукували штами P. aeruginosa, як в перші 24 години культивування, так і на 2 добу в середньому складав 0,674±0,17 ОЩ та 0,709±0,15 ОЩ відповідно. Дані показники для клінічних штамів A. baumannii знаходилися в межах 0,51±0,19 ОЩ на першу добу та 0,553±0,14 ОЩ через 48 годин.
Доведено, що всі досліджувані антисептичні засоби впливали на процес формування біоплівок клінічними ізолятами роду Pseudomonas spp. протягом перших 24 годин. Культивування штамів P. aeruginosa з розчином декасану у суббактеріостатичній концентрації пригнічувало утворення біоплівок, ступінь поглинання барвника якими складав 0,463±0,10 ОЩ. Проте, достовірної різниці, порівняно з контролем, не виявлено (рис. 1).
Рис. 1. Характеристика біоплівкоутворюючих властивостей клінічних штамів P. aeruginosa (n=13);
*- достовірність відмінностей показника ОЩ біоплівок у присутності декасану до показника ОЩ біоплівок без антисептичного
препарату через 24 год, р<0,05; ** — достовірність відмінностей показників ОЩ біоплівок у присутності горостену та декасану до показника
ОЩ біоплівок без антисептичного препарату через 48 год, р<0,05.
Рис. 2. Характеристика біоплівкоутворюючих властивостей клінічних штамів A. baumannii;
*- достовірність відмінностей показників ОЩ біоплівок у присутності горостену,
декасану та хлоргексидину до показника ОЩ біоплівок без антисептичного препарату через 48 годин, р<0,05.
Суббактеріостатичні концентрації горостену та хлоргексидину біглюконату суттєво не впливали на процес біоплівкоутворення клінічними ізолятами P.aeruginosa у перші 24 години культивування (0,485±0,13 ОЩ та 0,544±0,15 ОЩ відповідно), оскільки результати виявилися недостовірними порівняно з контролем.
Важливим завданням сучасної медицини є створення препаратів, що окрім запобігання утворенню біоплівок здатні руйнувати вже сформовані. З цією метою проведено дослідження впливу антисептичних засобів на 2 добу культивування збудників. В результаті встановлено, що антисептичні засоби групи четвертинних амонієвих сполук на основі декаметоксину у суббактеріосатичних концентраціях виражено впливали на процес відтворення біоплівок штамів P. aeruginosa. Присутність розчину декасану достовірно пригнічувала біоплівкоутворення через 48 годин даними клінічними ізолятами у 1,4 рази (0,509±0,13 ОЩ), порівняно з контролем, що культивувався 2 доби. Достовірне зменшення сформованих біоплівок P. aeruginosa також виявили при додаванні суббактеріостатичної концентрації горостену через 48 годин відтворення експерименту, у порівнянні з контролем. Так, ступінь поглинання барвника дводобовими біоплівками штамів P. aeruginosa. при дії горостену зменшився у 1,3 рази (0,532±0,14 ОЩ).
В присутності хлоргексидину біглюконату даний показник був наближеним до показників біоплівкоутворення у присутності горостену, однак при порівнянні ОЩ біоплівок P. aeruginosa через 48 годин культивування в присутності суббактеріостатичної концентрації хлоргексидину та дводобовим контролем достовірної різниці не виявили. Одержані дані засвідчили відсутність ефективної протимікробної дії антисептичного засобу хлоргексидину на сформовані біоплівки клінічних штамів P. aeruginosa.
Встановлено, що всі антисептичні засоби, що були використані у дослідженнях, не мали суттєвого впливу на формування біоплівок клінічними ізолятами A. baumannii протягом першої доби, оскільки порівняно з контролем результати виявилися недостовірними (рис. 2). Однак, при додаванні суббактеріостатичних концентрацій антисептиків на другу добу відтворення біоплівок, останні виявилися чутливими до дії використаних засобів. Найбільшу чутливість дводобових біоплівок A. baumannii було встановлено до дії суббактеріостатичних концентрацій декасану. При цьому спостерігали зниження утворення біоплівок у 2,7 разів (0,207±0,10 ОЩ), в порівнянні з дводобовими біоплівками даних штамів без антисептиків.
Встановлено суттєве пригнічення утворення біоплівок через 48 годин експерименту в присутності горостену та хлоргексидину біглюконату. Щільність біоплівок при додаванні горостену (0,243±0,11 ОЩ) була в 2,3 рази меншою від ОЩ біоплівок, утворених клінічними штамами A. baumannii без антисептиків. Суббактеріостатична концентрація хлоргексидину біглюконату зменшувала утворення біоплівок у 2,0 разів. Це підтверджує ефективність препаратів, що використовували у дослідженнях при лікуванні інфекцій на етапі уже сформованих біоплівок.
Висновки
- Грамнегативні неферментуючі збудники родів Pseudomonas spp. та Acinetobacter spp., що колонізують периімплантатну ділянку за умов ускладнень одонтоімплантації, володіють високими біоплівкоутворюючими властивостями.
- Декасан в суббактеріостатичній концентрації пригнічує утворення біоплівок клінічними штамами aeruginosa протягом перших 24 год культивування. Клінічні ізоляти P. aeruginosa, які знаходяться у сформованій біоплівковій формі, виявляють високу чутливість до суббактеріостатичних концентрацій антисептиків на основі декаметоксину (декасан, горостен).
- Присутність антисептичних засобів не впливає на процес утворення біоплівок клінічними штамами baumannii. в першу добу культивування, проте суббактеріостатичні концентрації декасану, горостену та хлоргексидину суттєво пригнічують сформовані дводобові біоплівкові форми A. baumannii.
Література
- Балко О. Б. Структурні компоненти і особливості організації біоплівки Pseudomonas aeruginosa / О.Б. Балко, Л.В. Авдєєва // Мікробіологічний журнал. – 2010. – №. 72,№ 4. – С. 28-33.
- Лобань Г.А. Мікробіолоія, вірусолопя та імунологія порожнини рота / Г.А. Лобань, В.І. Федорченко — Полтава: Верстка, 2003. — 123 с.
- Палій Г.К. Дослідження ефективності антимікробних препаратів у пацієнтів із запальними захворюваннями порожнини рота / Г.К. Палій, О.А. Назарчук, М.О. Фаустова [та ін.] // Вісник проблем біології і медицини. – 2016. — №2 (3). – С. 220-225.
- Петрушанко Т. А. Скрининговая диагностика микроэкологических нарушений полости рта / Т.А. Петрушанко, В.В. Череда, Г.А. Лобань // Клиническая лабораторная диагностика. — №6. — С.48-50
- Фаустова O. Етіологічна структура, біологічні властивості домінуючих збудників периімплантатного мукозиту / M. O. Фаустова, О. А. Назарчук, M. M. Ананьєва // Запорожский медицинский журнал. — 2017. — Т. 19, № 5 (104). — С. 652—657.
- Фаустова М. О. Протистрептококова активність антибіотиків і антисептиків / М.О. Фаустова, О.А. Назарчук, М.М. Ананьєва // Актуальні проблеми сучасної медицини: Вісник української медичної стоматологічної академії. – 2017. – Т. – №. 2 (58).– С. 58-60.
- Череда В.В. Скринінгова оцінка колонізаційної резистентності слизової оболонки порожнини рота / В.В. Череда, Т.О. Петрушанко, Г.А. Лобань // Вісник стоматології. — 2011. — №2 (75). — С. 33-35.
- Alhede Pseudomonas aeruginosa biofilms: mechanisms of immune evasion / M. Alhede, T. Bjarnsholt, M. Givskov [et al.] // Adv. Appl. Microbiol. – 2014. – Т. 86. – №. 1. – С. 40.
- Alipour N. Outbreak of hospital infection from biofilm-embedded pan drug-resistant Pseudomonas aeroginosa, due to a contaminated bronchoscope / N. Alipour, A. Karaqoz, A. Taner [et al.] // Tap Chi Y Hoc Du Phong. – 2017. — №2(2). – P. 54-83.
- Al-Kadmy I.M.S. Molecular characterization of Acinetobacter baumannii isolated from Iraqi hospital environment / I.M.S. AL-Kadmy, A.N.M. Ali, I.M.A. Salman [et al.] // New Microbes and New Infections. – 2018. — №21. – Р. 51-57.
- Christensen G.D. Adherence of Coagulase-Negative Staphylococci to Plastic Tissue Culture Plates: a Quantitative Model for the Adherence of Staphylococci to Medical Devices / G.
- Christensen, W.A. Simpson, J.J. Younger [et. al] // Journal of clinical microbiology. – 1985. — Vol. 22(No. 6). — P. 996-1006.
- Rybtke Pseudomonas aeruginosa biofilm infections: community structure, antimicrobial tolerance and immune response / M. Rybtke, L.D. Hultqvist, M. Givskov [et al.] // Journal of molecular biology. – 2015. – Т. 427. – №. 23. – С. 3628-3645.
- Vasanthi R. Study of biofilm production and antimicrobial resistance pattern of the bacterial isolates from invasive devices /
- Vasanthi, D. Karthikeyan, M. Jeya // International Journal of Research in Health Sciences. – 2014. – V. 2 (1). – P. 274-280.